Bunyi hukum faraday 1: “Massa zat yang dihasilkan suatu elektrode selama proses elektrolisis berbanding lurus atau sama dengan muatan listrik yang digunakan”. Rumus Hukum Faraday 1 dan Contoh Soalnya

Hukum faraday 1 berbunyi:
W= e.i.t/96500
W=masa endapan
e= Ar/valensi
i = Arus
t = waktu
Q = i.t
W= e.Q/96500
F = Q/96500
W= e.F
1 mol e- =1 Faraday
Baca juga: Reaksi Sel Elektrolisis dan Contoh Soalnya
Contoh soal Hukum Faraday 1:
Berikut beberapa contoh soal hukum faraday 1:
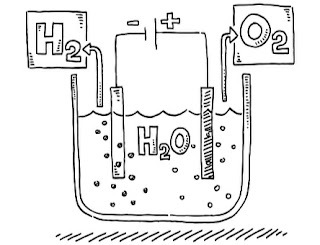
1. Dalam larutan elektrolisis Cu (NO3)2 dengan inert elektroda, 1,27 gram Cu (Ar, Cu = 63,5) diendapkan, volume gas yang dihasilkan di anoda pada 1 atm dan 0 ° C adalah …
Pertama tentukan reaksi elektrolisisnya:
Cu(No3)2 dalam keadaan inert
Katoda/reduksi:
Katoda/reduksi: Cu²+ +2e- —> Cu
Anoda/oksidasi: 2H2O—> 4H+ +O2 +e-
Dik mol Cu= gr/Ar
=1,27/63,5
=0,02
Cu²+ +2e- —> Cu
Maka 2 e- Cu= 0,02×2
=0,04
karena elektron bergerak sama di katoda dan anoda, maka mole elektron di 4H+ adalah 0,04.
4H+ = 0,04
O2 = 1/4 × 0,04
O2 = 0,01
Ditanyakan Volume gas pada keadaan standar STP
V= n×22,4
V=0,01×22,4
V=0,224
2. Contoh ke-dua






Tinggalkan komentar