20.6 Beberapa Aplikasi Hukum Pertama Termodinamika
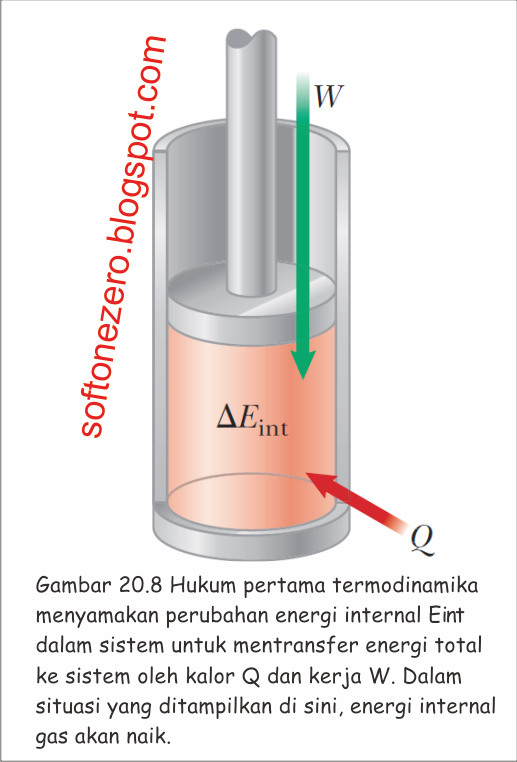
Pada bagian ini, kita mempertimbangkan aplikasi dari hukum pertama terhadap proses melalui gas yang diambil. Sebagai model, mari kita pertimbangkan sampel gas yang terkandung dalam bagian piston silinder pada Gambar 20.8. Hal ini menunjukkan usaha yang dilakukan pada gas dan energi ditransfer ke dalam oleh panas, sehingga energi internal gas meningkat. Dalam diskusi berikut mengenai berbagai proses, merujuk kembali ke figur ini dan secara mental mengubah arah transfer energi untuk mencerminkan apa yang terjadi pada proses.
Sebelum kita menerapkan hukum pertama termodinamika untuk sistem tertentu, ini berguna untuk terlebih dahulu menetapkan beberapa proses termodinamika ideal. Sebuah proses adiabatik adalah salah satu di mana tidak ada energi yang memasuki atau meninggalkan sistem dengan panas, yaitu, Q = 0. Sebuah proses adiabatik dapat dicapai baik oleh isolasi termal dinding sistem atau dengan melakukan proses pesat sehingga ada waktu yang diabaikan untuk energi yang ditransfer oleh panas. Menerapkan hukum pertama termodinamika untuk proses adiabatik memberikan:
∆Eint = W (proses adiabatik) (20.11)
Hasil ini menunjukkan bahwa jika gas dikompresi adiabatik sehingga W adalah positif, maka ∆Eintpositif dan suhu gas akan naik. Sebaliknya, suhu gas menurun saat gas mengembang adiabatik.
Proses adiabatik sangat penting dalam praktek rekayasa. Beberapa contoh umum adalah ekspansi gas panas di mesin pembakaran internal, pencairan gas dalam sistem pendingin, dan langkah kompresi dalam mesin diesel.
Proses yang diuraikan pada Gambar 20.7c dan 20.7d, disebut ekspansi bebas adiabatik, adalah unik. Proses ini adiabatik karena berlangsung dalam wadah terisolasi. Karena gas berekspansi ke ruang hampa, itu tidak berlaku gaya pada piston seperti halnya gas dalam peristiwa 20.7a dan 20.7b, sehingga tidak ada usaha yang dilakukan pada atau oleh gas. Oleh karena itu, dalam proses adiabatik ini, baik Q = 0 dan W = 0. Akibatnya, ∆Eint = 0 untuk proses ini dapat dilihat dari hukum pertama. Artinya, energi internal yang awal dan akhir dari gas adalah sama dalam ekspansi bebas adiabatik. Sebagaimana akan kita lihat dalam Bab 21, energi internal gas ideal hanya bergantung pada suhu. Oleh karena itu, kita berharap ada perubahan suhu selama ekspansi bebas adiabatik. Prediksi ini sesuai dengan hasil uji coba yang dilakukan pada tekanan rendah. (Uji coba yang dilakukan pada tekanan tinggi untuk gas nyata menunjukkan sedikit perubahan suhu setelah perluasan akibat interaksi antarmolekul, yang merupakan penyimpangan dari model gas ideal.).
Sebuah proses yang terjadi pada tekanan konstan disebut proses isobarik. Dalam Gambar 20.8, proses isobarik dapat dibentuk dengan membiarkan piston bergerak bebas sehingga selalu dalam keseimbangan antara gaya total dari gas yang menekan ke atas dan berat piston ditambah gaya akibat tekanan atmosfer yang mendorong ke bawah. Proses pertama dalam Gambar 20.6a dan proses kedua Gambar 20.6b keduanya isobarik.
Dalam proses tersebut, nilai-nilai dari kalor dan usaha, keduanya biasanya nol. Usaha yang dilakukan gas dalam proses isobarik hanya:
W = -P (Vf – Vi) (proses isobarik) (20.12)
di mana P adalah tekanan konstan gas selama proses tersebut.
di mana P adalah tekanan konstan gas selama proses tersebut.
Sebuah proses yang terjadi pada volume konstan disebut proses isovolumetric. Dalam Gambar 20.8, menjepit piston pada posisi tetap akan memastikan proses isovolumetric. Proses kedua pada Gambar 20.6a dan proses pertama dalam Gambar 20.6b keduanya isovolumetric.
Karena volume gas tidak berubah dalam proses tersebut, usaha yang diberikan oleh Persamaan 20.9 adalah nol. Oleh karena itu, dari hukum pertama kita melihat bahwa dalam proses isovolumetric, karena W = 0,
∆Eint = Q (proses isovolumetric) (20,13)
Ungkapan ini menetapkan bahwa jika energi ditambahkan oleh kalor ke sistem disimpan pada volume konstan, semua energi yang ditransfer tetap dalam sistem sebagai peningkatan energi internal. Misalnya, ketika sekaleng cat semprot dilemparkan ke dalam api, energi memasuki sistem (gas di dapat) oleh kalor melalui dinding logam dari kaleng. Akibatnya, suhu dan karena tekanan, dalam kaleng meningkat sampai mungkin bisa meledak.
Ungkapan ini menetapkan bahwa jika energi ditambahkan oleh kalor ke sistem disimpan pada volume konstan, semua energi yang ditransfer tetap dalam sistem sebagai peningkatan energi internal. Misalnya, ketika sekaleng cat semprot dilemparkan ke dalam api, energi memasuki sistem (gas di dapat) oleh kalor melalui dinding logam dari kaleng. Akibatnya, suhu dan karena tekanan, dalam kaleng meningkat sampai mungkin bisa meledak.
Sebuah proses yang terjadi pada suhu konstan disebut proses isotermal. Proses ini dapat dilakukan dengan merendam silinder pada Gambar 20.8 dalam penangas es-air atau dengan menempatkan silinder dalam kontak dengan beberapa waduk bersuhu konstan lainnya. Sebuah plot P-V pada suhu konstan untuk gas ideal menghasilkan kurva hiperbolik yang disebut isoterm. Energi internal gas ideal merupakan fungsi dari suhu saja. Oleh karena itu, dalam proses isotermal melibatkan gas ideal, ∆Eint= 0. Untuk proses isotermal, kita simpulkan dari hukum pertama bahwa transfer energi Q harus sama dengan negatif dari kerja yang dilakukan pada gas, yaitu, Q = -W. Setiap energi yang masuk sistem dengan kalor yang dipindahkan dari sistem dengan usaha, sebagai akibatnya, tidak ada perubahan energi internal sistem terjadi dalam proses isotermal.
Ekspansi isotermal dari Gas Ideal
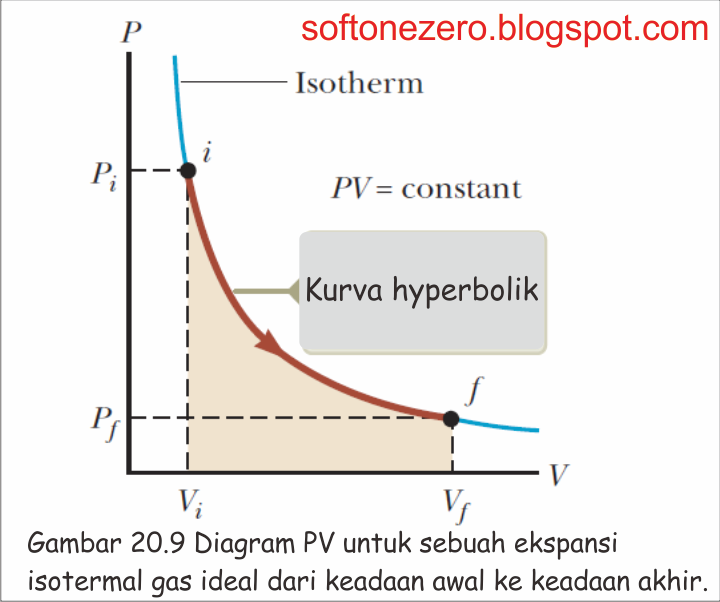
Misalkan suatu gas ideal diperbolehkan untuk memperluas kuasi-statis pada suhu konstan. Proses ini dijelaskan oleh diagram PV yang ditunjukkan pada Gambar 20.9. Kurva ini adalah hiperbola (Persamaan. B.23), dan hukum gas ideal (Persamaan 19.8) dan dengan konstan T menunjukkan bahwa persamaan kurva ini adalah PV = nRT = konstan.
Mari kita menghitung usaha yang dilakukan pada gas dalam ekspansi dari keadaan i ke keadaan f. Usaha yang dilakukan pada gas diberikan oleh Persamaan 20.9. Karena gas ideal dan proses yang kuasi-statis, hukum gas ideal berlaku untuk setiap titik pada garis. Oleh karena itu,
Karena T adalah konstan dalam hal ini, dapat dihapus dari integral bersama dengan n dan R:
Untuk mengevaluasi integral, kita menggunakan e (dx / x) ln x 5. (Lihat Lampiran B.) Mengevaluasi hasil pada volume awal dan akhir ini memberikan:
Secara numerik, usaha ini sama dengan W negatif dari daerah yang diarsir di bawah kurva PV yang ditunjukkan pada Gambar 20.9. Karena gas mengembang, Vf > Vi dan nilai kerja yang dilakukan pada gas adalah negatif seperti yang kita harapkan. Jika gas yang dikompresi, maka Vf < Vidan kerja yang dilakukan pada gas adalah positif (Serway, 579-581 : 2010).
Baca Juga Tentang: Hukum Pertama Termodinamika
//Anda baru saja membaca artikel tentang BEBERAPA APLIKASI HUKUM PERTAMA TERMODINAMIKA, jika ada yang kurang jelas, keliru, kritik dan sarannya mohon isi di kolom komentar.//






Tinggalkan komentar